به این علت ظرفهای محتوی آن ، همیشه تحت فشار کنترل شده میباشد. اسید نیتریک با آب قابل احتراق است و محلول آن آزئوتروپی را تشکیل میدهد که نقطه جوش آن برابر با 121.9 درجه سانتیگراد است که شامل 68.7% وزنی HNO3 میباشد.

روشهای تهیه اسید نیتریک
امروزه در تولید صنعتی اسید نیتریک ، آمونیاک بعنوان ماده اولیه استفاده میشود. از نظر تاریخی ، اسید نیتریک اولین بار از اثر اسید سولفوریک روی نیترات سدیم (شوره شیلی ) بدست آمد. واکنش در کورههایی با دمای 150 تا 170 درجه سانتیگراد صورت میگیرد. اسید بدست آمده ، دارای غلظت 95 تا 97 درصد است.
روش بریک لند ( Brikeland )
در این روش میتوان اسید نیتریک را از اکسید نیتریک مطابق واکنش زیر بدست آورد.
تبدیل NO به HNO3 با اکسیداسیون و هیدراتاسیون انجام میگیرد. در این فرایند بخاطر کم بودن غلظت NO ، علاوه بر هزینه انرژی الکتریکی ، مقداری گاز نیز باید در جریان باشد. ضمنا دمای بالا نیز باعث واکنش عکس و تجزیه NO میشود.
سنتز اسید نیتریک از آمونیاک
امروزه اسید نیتریک بطور صنعتی از آمونیاک تهیه میشود. برای این کار لازم است که ماده اولیه را با هوا به اکسید نیتروژن تبدیل کرد.
کاتالیزور مورد استفاده در اکسیداسیون NH3 به NO
تنها کاتالیزور صنعتی برای اکسیداسیون NH3 به NO ، آلیاژ پلاتین رودیوم است که تقریبا 10٪ آن رودیوم است. رودیوم ، خواص کاتالیزوری پلاتین را اصلاح کرده ، خواص مکانیکی و ضد سایش را افزایش میدهد. این کاتالیزور معمولا بصورت توری با رشتههای باریک (قطر آن 0,05mm) میباشد. موقعی که کاتالیزور فعالترین حالت را دارا است، آمونیاک را از روی آن عبور داده و 98٪ NO بدست میآورند.
سموم کاتالیزور
کلریدها ، سولفاتها مانند H2S ، CoS ، H2S ، As2O2 ، سموم دایمی کاتالیزور بکار رفته در احتراق NH3 به NO هستند. هیدرو کربنهایی مثل استیلن و اتیلن سموم موقتی هستند. با حذف هوا از محیط ، اثر آنها از بین میرود. چربیها ، گرد و غبار و مواد ساینده و روان کننده ، سطح فعال کاتالیزور را کم کرده ، منجر به گرفتگی سوراخهای توری و از کار افتادن آن میشود.
تکنولوژی اکسیداسیون NH3 به NO
با اینکه امروزه اصلاحاتی از قبیل احیای کاتالیتها و غیره صورت گرفته است، ولی کورههای احتراق بکار رفته در تبدیل NH3 به NO ، همان کورههای احتراق کلاسیک میباشند که عبارتند از:
کورههای Frank-Bomag
این کوره از پائین با هوا و آمونیاک گازی تغذیه میشود که قبلا با مبادله کنندههایی گرم شدهاند.
کوره احتراق Parson
مخلوط مواد اولیه قبل از ورود به کوره با یک مبادله کننده گرم شده ، سپس از بالای کوره وارد شده ، بعد از رد شدن از کاتالیست زنبیل مانند به ته کوره میروند.
کورههای Dupton
این کورهها به شکل کورههای فرانک ( Frank ) هستند، ولی به روش Parson تغذیه میشوند. این کوره در فشار 6atm کار میکند.
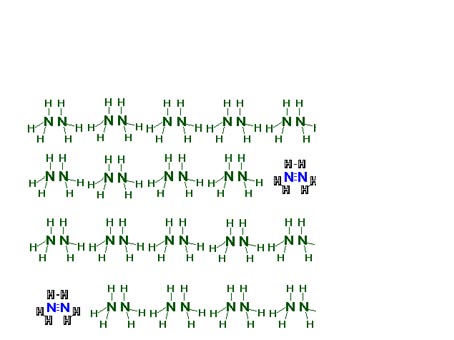
فرآیند شیمیایی تبدیل NH3 به NO
- تبدیل NO به NO2
- تبدیل NO2 در مجاورت آب به مخلوط HNO2 ،HNO3
- تبدیل اسید نیترو در اثر تسهیم نامتناسب به اسید نیتریک و NO که مرحله پایانی فرآیند است.
روشهای تولید اسید نیتریک از NO
روشهای مورد استفاده مختلف بوده ، بستگی به محصول نهایی دارند. کارخانهها میتوانند 50 _60% از اسید نیتریک را با غلظت احتمالی 96_98 % با بکارگیری اسید سولفوریک یا نیترات منیزیم تولید کنند. استفاده از روش نیترات منیزیم مقرون به صرفهتر است.
نگهداری و حمل و نقل اسید نیتریک
اسید نیتریک 50 _ 60% را باید در ظرفهای فولاد زنگ نزن یا ظروف سفالی یا بطریهای تیره محافظت شده حمل کرد و غلظتهای بالاتر از آن را باید در ظروف آلومینیومی غیر فعال نگهداری و حمل کرد.اسید نیتریک خالص (HNO3) در 41.6- درجه سانتیگراد ذوب شده ، تولید مایع بیرنگی میکند، اما نسبت به درجه حرارت و درجه تابش نور بر آن ، گستره رنگ آن از زرد تا قرمز متمایل به قهوهای متغیر است. این تغییرات نتیجه تجزیه آن طبق واکنش زیر است:
به این علت ظرفهای محتوی آن ، همیشه تحت فشار کنترل شده میباشد. اسید نیتریک با آب قابل احتراق است و محلول آن آزئوتروپی را تشکیل میدهد که نقطه جوش آن برابر با 121.9 درجه سانتیگراد است که شامل 68.7% وزنی HNO3 میباشد.

روشهای تهیه اسید نیتریک
امروزه در تولید صنعتی اسید نیتریک ، آمونیاک بعنوان ماده اولیه استفاده میشود. از نظر تاریخی ، اسید نیتریک اولین بار از اثر اسید سولفوریک روی نیترات سدیم (شوره شیلی ) بدست آمد. واکنش در کورههایی با دمای 150 تا 170 درجه سانتیگراد صورت میگیرد. اسید بدست آمده ، دارای غلظت 95 تا 97 درصد است.
روش بریک لند ( Brikeland )
در این روش میتوان اسید نیتریک را از اکسید نیتریک مطابق واکنش زیر بدست آورد.
تبدیل NO به HNO3 با اکسیداسیون و هیدراتاسیون انجام میگیرد. در این فرایند بخاطر کم بودن غلظت NO ، علاوه بر هزینه انرژی الکتریکی ، مقداری گاز نیز باید در جریان باشد. ضمنا دمای بالا نیز باعث واکنش عکس و تجزیه NO میشود.
سنتز اسید نیتریک از آمونیاک
امروزه اسید نیتریک بطور صنعتی از آمونیاک تهیه میشود. برای این کار لازم است که ماده اولیه را با هوا به اکسید نیتروژن تبدیل کرد.
کاتالیزور مورد استفاده در اکسیداسیون NH3 به NO
تنها کاتالیزور صنعتی برای اکسیداسیون NH3 به NO ، آلیاژ پلاتین رودیوم است که تقریبا 10٪ آن رودیوم است. رودیوم ، خواص کاتالیزوری پلاتین را اصلاح کرده ، خواص مکانیکی و ضد سایش را افزایش میدهد. این کاتالیزور معمولا بصورت توری با رشتههای باریک (قطر آن 0,05mm) میباشد. موقعی که کاتالیزور فعالترین حالت را دارا است، آمونیاک را از روی آن عبور داده و 98٪ NO بدست میآورند.
سموم کاتالیزور
کلریدها ، سولفاتها مانند H2S ، CoS ، H2S ، As2O2 ، سموم دایمی کاتالیزور بکار رفته در احتراق NH3 به NO هستند. هیدرو کربنهایی مثل استیلن و اتیلن سموم موقتی هستند. با حذف هوا از محیط ، اثر آنها از بین میرود. چربیها ، گرد و غبار و مواد ساینده و روان کننده ، سطح فعال کاتالیزور را کم کرده ، منجر به گرفتگی سوراخهای توری و از کار افتادن آن میشود.
تکنولوژی اکسیداسیون NH3 به NO
با اینکه امروزه اصلاحاتی از قبیل احیای کاتالیتها و غیره صورت گرفته است، ولی کورههای احتراق بکار رفته در تبدیل NH3 به NO ، همان کورههای احتراق کلاسیک میباشند که عبارتند از:
کورههای Frank-Bomag
این کوره از پائین با هوا و آمونیاک گازی تغذیه میشود که قبلا با مبادله کنندههایی گرم شدهاند.
کوره احتراق Parson
مخلوط مواد اولیه قبل از ورود به کوره با یک مبادله کننده گرم شده ، سپس از بالای کوره وارد شده ، بعد از رد شدن از کاتالیست زنبیل مانند به ته کوره میروند.
کورههای Dupton
این کورهها به شکل کورههای فرانک ( Frank ) هستند، ولی به روش Parson تغذیه میشوند. این کوره در فشار 6atm کار میکند.

فرآیند شیمیایی تبدیل NH3 به NO
- تبدیل NO به NO2
- تبدیل NO2 در مجاورت آب به مخلوط HNO2 ،HNO3
- تبدیل اسید نیترو در اثر تسهیم نامتناسب به اسید نیتریک و NO که مرحله پایانی فرآیند است.
روشهای تولید اسید نیتریک از NO
روشهای مورد استفاده مختلف بوده ، بستگی به محصول نهایی دارند. کارخانهها میتوانند 50 _60% از اسید نیتریک را با غلظت احتمالی 96_98 % با بکارگیری اسید سولفوریک یا نیترات منیزیم تولید کنند. استفاده از روش نیترات منیزیم مقرون به صرفهتر است.
نگهداری و حمل و نقل اسید نیتریک
اسید نیتریک 50 _ 60% را باید در ظرفهای فولاد زنگ نزن یا ظروف سفالی یا بطریهای تیره محافظت شده حمل کرد و غلظتهای بالاتر از آن را باید در ظروف آلومینیومی غیر فعال نگهداری و حمل کرد.اسید نیتریک خالص (HNO3) در 41.6- درجه سانتیگراد ذوب شده ، تولید مایع بیرنگی میکند، اما نسبت به درجه حرارت و درجه تابش نور بر آن ، گستره رنگ آن از زرد تا قرمز متمایل به قهوهای متغیر است. این تغییرات نتیجه تجزیه آن طبق واکنش زیر است:
به این علت ظرفهای محتوی آن ، همیشه تحت فشار کنترل شده میباشد. اسید نیتریک با آب قابل احتراق است و محلول آن آزئوتروپی را تشکیل میدهد که نقطه جوش آن برابر با 121.9 درجه سانتیگراد است که شامل 68.7% وزنی HNO3 میباشد.

روشهای تهیه اسید نیتریک
امروزه در تولید صنعتی اسید نیتریک ، آمونیاک بعنوان ماده اولیه استفاده میشود. از نظر تاریخی ، اسید نیتریک اولین بار از اثر اسید سولفوریک روی نیترات سدیم (شوره شیلی ) بدست آمد. واکنش در کورههایی با دمای 150 تا 170 درجه سانتیگراد صورت میگیرد. اسید بدست آمده ، دارای غلظت 95 تا 97 درصد است.
روش بریک لند ( Brikeland )
در این روش میتوان اسید نیتریک را از اکسید نیتریک مطابق واکنش زیر بدست آورد.
تبدیل NO به HNO3 با اکسیداسیون و هیدراتاسیون انجام میگیرد. در این فرایند بخاطر کم بودن غلظت NO ، علاوه بر هزینه انرژی الکتریکی ، مقداری گاز نیز باید در جریان باشد. ضمنا دمای بالا نیز باعث واکنش عکس و تجزیه NO میشود.
سنتز اسید نیتریک از آمونیاک
امروزه اسید نیتریک بطور صنعتی از آمونیاک تهیه میشود. برای این کار لازم است که ماده اولیه را با هوا به اکسید نیتروژن تبدیل کرد.
کاتالیزور مورد استفاده در اکسیداسیون NH3 به NO
تنها کاتالیزور صنعتی برای اکسیداسیون NH3 به NO ، آلیاژ پلاتین رودیوم است که تقریبا 10٪ آن رودیوم است. رودیوم ، خواص کاتالیزوری پلاتین را اصلاح کرده ، خواص مکانیکی و ضد سایش را افزایش میدهد. این کاتالیزور معمولا بصورت توری با رشتههای باریک (قطر آن 0,05mm) میباشد. موقعی که کاتالیزور فعالترین حالت را دارا است، آمونیاک را از روی آن عبور داده و 98٪ NO بدست میآورند.
سموم کاتالیزور
کلریدها ، سولفاتها مانند H2S ، CoS ، H2S ، As2O2 ، سموم دایمی کاتالیزور بکار رفته در احتراق NH3 به NO هستند. هیدرو کربنهایی مثل استیلن و اتیلن سموم موقتی هستند. با حذف هوا از محیط ، اثر آنها از بین میرود. چربیها ، گرد و غبار و مواد ساینده و روان کننده ، سطح فعال کاتالیزور را کم کرده ، منجر به گرفتگی سوراخهای توری و از کار افتادن آن میشود.
تکنولوژی اکسیداسیون NH3 به NO
با اینکه امروزه اصلاحاتی از قبیل احیای کاتالیتها و غیره صورت گرفته است، ولی کورههای احتراق بکار رفته در تبدیل NH3 به NO ، همان کورههای احتراق کلاسیک میباشند که عبارتند از:
کورههای Frank-Bomag
این کوره از پائین با هوا و آمونیاک گازی تغذیه میشود که قبلا با مبادله کنندههایی گرم شدهاند.
کوره احتراق Parson
مخلوط مواد اولیه قبل از ورود به کوره با یک مبادله کننده گرم شده ، سپس از بالای کوره وارد شده ، بعد از رد شدن از کاتالیست زنبیل مانند به ته کوره میروند.
کورههای Dupton
این کورهها به شکل کورههای فرانک ( Frank ) هستند، ولی به روش Parson تغذیه میشوند. این کوره در فشار 6atm کار میکند.

فرآیند شیمیایی تبدیل NH3 به NO
- تبدیل NO به NO2
- تبدیل NO2 در مجاورت آب به مخلوط HNO2 ،HNO3
- تبدیل اسید نیترو در اثر تسهیم نامتناسب به اسید نیتریک و NO که مرحله پایانی فرآیند است.
روشهای تولید اسید نیتریک از NO
روشهای مورد استفاده مختلف بوده ، بستگی به محصول نهایی دارند. کارخانهها میتوانند 50 _60% از اسید نیتریک را با غلظت احتمالی 96_98 % با بکارگیری اسید سولفوریک یا نیترات منیزیم تولید کنند. استفاده از روش نیترات منیزیم مقرون به صرفهتر است.
نگهداری و حمل و نقل اسید نیتریک
اسید نیتریک 50 _ 60% را باید در ظرفهای فولاد زنگ نزن یا ظروف سفالی یا بطریهای تیره محافظت شده حمل کرد و غلظتهای بالاتر از آن را باید در ظروف آلومینیومی غیر فعال نگهداری و حمل کرد.اسید نیتریک خالص (HNO3) در 41.6- درجه سانتیگراد ذوب شده ، تولید مایع بیرنگی میکند، اما نسبت به درجه حرارت و درجه تابش نور بر آن ، گستره رنگ آن از زرد تا قرمز متمایل به قهوهای متغیر است. این تغییرات نتیجه تجزیه آن طبق واکنش زیر است:
به این علت ظرفهای محتوی آن ، همیشه تحت فشار کنترل شده میباشد. اسید نیتریک با آب قابل احتراق است و محلول آن آزئوتروپی را تشکیل میدهد که نقطه جوش آن برابر با 121.9 درجه سانتیگراد است که شامل 68.7% وزنی HNO3 میباشد.

روشهای تهیه اسید نیتریک
امروزه در تولید صنعتی اسید نیتریک ، آمونیاک بعنوان ماده اولیه استفاده میشود. از نظر تاریخی ، اسید نیتریک اولین بار از اثر اسید سولفوریک روی نیترات سدیم (شوره شیلی ) بدست آمد. واکنش در کورههایی با دمای 150 تا 170 درجه سانتیگراد صورت میگیرد. اسید بدست آمده ، دارای غلظت 95 تا 97 درصد است.
روش بریک لند ( Brikeland )
در این روش میتوان اسید نیتریک را از اکسید نیتریک مطابق واکنش زیر بدست آورد.
تبدیل NO به HNO3 با اکسیداسیون و هیدراتاسیون انجام میگیرد. در این فرایند بخاطر کم بودن غلظت NO ، علاوه بر هزینه انرژی الکتریکی ، مقداری گاز نیز باید در جریان باشد. ضمنا دمای بالا نیز باعث واکنش عکس و تجزیه NO میشود.
سنتز اسید نیتریک از آمونیاک
امروزه اسید نیتریک بطور صنعتی از آمونیاک تهیه میشود. برای این کار لازم است که ماده اولیه را با هوا به اکسید نیتروژن تبدیل کرد.
کاتالیزور مورد استفاده در اکسیداسیون NH3 به NO
تنها کاتالیزور صنعتی برای اکسیداسیون NH3 به NO ، آلیاژ پلاتین رودیوم است که تقریبا 10٪ آن رودیوم است. رودیوم ، خواص کاتالیزوری پلاتین را اصلاح کرده ، خواص مکانیکی و ضد سایش را افزایش میدهد. این کاتالیزور معمولا بصورت توری با رشتههای باریک (قطر آن 0,05mm) میباشد. موقعی که کاتالیزور فعالترین حالت را دارا است، آمونیاک را از روی آن عبور داده و 98٪ NO بدست میآورند.
سموم کاتالیزور
کلریدها ، سولفاتها مانند H2S ، CoS ، H2S ، As2O2 ، سموم دایمی کاتالیزور بکار رفته در احتراق NH3 به NO هستند. هیدرو کربنهایی مثل استیلن و اتیلن سموم موقتی هستند. با حذف هوا از محیط ، اثر آنها از بین میرود. چربیها ، گرد و غبار و مواد ساینده و روان کننده ، سطح فعال کاتالیزور را کم کرده ، منجر به گرفتگی سوراخهای توری و از کار افتادن آن میشود.
تکنولوژی اکسیداسیون NH3 به NO
با اینکه امروزه اصلاحاتی از قبیل احیای کاتالیتها و غیره صورت گرفته است، ولی کورههای احتراق بکار رفته در تبدیل NH3 به NO ، همان کورههای احتراق کلاسیک میباشند که عبارتند از:
کورههای Frank-Bomag
این کوره از پائین با هوا و آمونیاک گازی تغذیه میشود که قبلا با مبادله کنندههایی گرم شدهاند.
کوره احتراق Parson
مخلوط مواد اولیه قبل از ورود به کوره با یک مبادله کننده گرم شده ، سپس از بالای کوره وارد شده ، بعد از رد شدن از کاتالیست زنبیل مانند به ته کوره میروند.
کورههای Dupton
این کورهها به شکل کورههای فرانک ( Frank ) هستند، ولی به روش Parson تغذیه میشوند. این کوره در فشار 6atm کار میکند.

فرآیند شیمیایی تبدیل NH3 به NO
- تبدیل NO به NO2
- تبدیل NO2 در مجاورت آب به مخلوط HNO2 ،HNO3
- تبدیل اسید نیترو در اثر تسهیم نامتناسب به اسید نیتریک و NO که مرحله پایانی فرآیند است.
روشهای تولید اسید نیتریک از NO
روشهای مورد استفاده مختلف بوده ، بستگی به محصول نهایی دارند. کارخانهها میتوانند 50 _60% از اسید نیتریک را با غلظت احتمالی 96_98 % با بکارگیری اسید سولفوریک یا نیترات منیزیم تولید کنند. استفاده از روش نیترات منیزیم مقرون به صرفهتر است.
نگهداری و حمل و نقل اسید نیتریک
اسید نیتریک 50 _ 60% را باید در ظرفهای فولاد زنگ نزن یا ظروف سفالی یا بطریهای تیره محافظت شده حمل کرد و غلظتهای بالاتر از آن را باید در ظروف آلومینیومی غیر فعال نگهداری و حمل کرد.



 سرامیک مشتق از کلمه keramos یونانی است که به معنی سفالینه یا شئی پخته شده است. در واقع منشا پیدایش این علم همان سفالینههای ساخته شده توسط انسانهای اولیه هستند. در واقع قبل از کشف و استفاده فلزات، بشر از گلهای رس به علت وفور و فراوانی آنها و همچنین شکلگیری بسیار خوب آنها در در صورت مخلوط شدن با آب و درجه حرارت نسبتاً پایین پخت آنها استفاده میکرد. آلومینوسیلیکاتها که خاکهای رسی خود آنها به حساب میآیند، از عناصر آلومینیوم، سیلیسم و اکسیژن ساخته میشوند که این سه عنصر بر روی هم حدود 85 درصد پوسته جامد کره زمین را تشکیل میدهند. این سه عنصر فراوانترین عناصر پوسته زمین هستند.
سرامیک مشتق از کلمه keramos یونانی است که به معنی سفالینه یا شئی پخته شده است. در واقع منشا پیدایش این علم همان سفالینههای ساخته شده توسط انسانهای اولیه هستند. در واقع قبل از کشف و استفاده فلزات، بشر از گلهای رس به علت وفور و فراوانی آنها و همچنین شکلگیری بسیار خوب آنها در در صورت مخلوط شدن با آب و درجه حرارت نسبتاً پایین پخت آنها استفاده میکرد. آلومینوسیلیکاتها که خاکهای رسی خود آنها به حساب میآیند، از عناصر آلومینیوم، سیلیسم و اکسیژن ساخته میشوند که این سه عنصر بر روی هم حدود 85 درصد پوسته جامد کره زمین را تشکیل میدهند. این سه عنصر فراوانترین عناصر پوسته زمین هستند.